
E-E-A-T médical : Construire du contenu de santé fiable pour l’IA
Découvrez comment créer du contenu santé fiable en appliquant les principes E-E-A-T. Découvrez des stratégies pour établir l’autorité médicale, l’expertise et l...
La conformité de l’IA en santé fait référence au respect, par les systèmes d’intelligence artificielle utilisés dans le secteur de la santé, des normes réglementaires, juridiques et éthiques qui encadrent leur développement, leur déploiement et leur fonctionnement. Elle englobe les exigences en matière d’exactitude médicale, de sécurité des patients, de protection des données et d’efficacité clinique dans de multiples juridictions. Le paysage de la conformité s’appuie sur les normes YMYL (Your Money or Your Life) et les exigences d’exactitude médicale qui imposent une validation fondée sur des preuves des allégations cliniques.
La conformité de l’IA en santé fait référence au respect, par les systèmes d’intelligence artificielle utilisés dans le secteur de la santé, des normes réglementaires, juridiques et éthiques qui encadrent leur développement, leur déploiement et leur fonctionnement. Elle englobe les exigences en matière d’exactitude médicale, de sécurité des patients, de protection des données et d’efficacité clinique dans de multiples juridictions. Le paysage de la conformité s’appuie sur les normes YMYL (Your Money or Your Life) et les exigences d’exactitude médicale qui imposent une validation fondée sur des preuves des allégations cliniques.
La conformité de l’IA en santé fait référence au respect, par les systèmes d’intelligence artificielle utilisés dans le secteur de la santé, des normes réglementaires, juridiques et éthiques qui encadrent leur développement, leur déploiement et leur fonctionnement. Cela englobe un cadre complet garantissant que les solutions de santé pilotées par l’IA respectent des exigences strictes en matière d’exactitude médicale, de sécurité des patients, de protection des données et d’efficacité clinique. L’importance de la conformité de l’IA en santé ne saurait être surestimée, car le non-respect peut entraîner des préjudices pour les patients, des sanctions réglementaires, une perte de crédibilité clinique et une responsabilité juridique pour les organisations de santé et les fournisseurs technologiques. Le paysage de la conformité repose sur deux piliers fondamentaux : les normes YMYL (Your Money or Your Life) qui mettent l’accent sur la fiabilité des contenus et les exigences d’exactitude médicale qui imposent une validation fondée sur des preuves des allégations cliniques. Les organisations déployant l’IA en santé doivent naviguer dans des exigences réglementaires complexes à travers de multiples juridictions tout en maintenant les plus hauts standards de transparence et de responsabilité.

YMYL (Your Money or Your Life) est un concept de qualité de recherche Google qui identifie les catégories de contenu où l’inexactitude pourrait avoir un impact direct sur la santé, la sécurité, la stabilité financière ou le bien-être de l’utilisateur. Dans le contexte de la santé, YMYL s’applique à tout système d’IA fournissant des informations médicales, une assistance au diagnostic, des recommandations de traitement ou des conseils de santé, car ceux-ci influencent directement des décisions de santé critiques. Les critères E-E-A-T de Google—Expertise, Expérience, Autorité et Fiabilité—établissent le seuil de qualité pour les contenus santé, exigeant que les systèmes d’IA démontrent des connaissances cliniques, une validation en conditions réelles, une autorité reconnue dans les domaines médicaux et une fiabilité constante. Les systèmes d’IA santé doivent répondre aux normes YMYL en veillant à ce que toutes les allégations médicales soient étayées par des preuves cliniques, en divulguant clairement l’implication de l’IA dans les recommandations et en maintenant une documentation transparente des sources de données d’entraînement et des méthodologies de validation. Une exigence essentielle pour la conformité YMYL en santé est la validation par un clinicien agréé, où des professionnels médicaux qualifiés valident les résultats de l’IA avant le déploiement clinique et mettent en place des mécanismes de supervision pour la surveillance continue des performances. Le tableau ci-dessous illustre la façon dont les exigences YMYL se traduisent en normes d’implémentation spécifiques pour l’IA santé :
| Exigence | Norme YMYL | Implémentation IA en santé |
|---|---|---|
| Exactitude du contenu | Les allégations doivent être factuellement correctes et fondées sur des preuves | Algorithmes d’IA validés par rapport aux standards cliniques de référence avec des métriques de sensibilité/spécificité documentées |
| Autorité de la source | Contenu créé par des experts reconnus | Systèmes d’IA développés avec des comités consultatifs cliniques et des études de validation évaluées par des pairs |
| Transparence | Divulgation claire des limites du contenu | Étiquetage explicite de l’implication de l’IA, scores de confiance et limites des recommandations dans les interfaces utilisateur |
| Démonstration d’expertise | Connaissances démontrées dans le domaine concerné | Protocoles de relecture clinicienne, formation continue pour les développeurs IA et expertise clinique documentée des équipes de validation |
| Signaux de confiance utilisateur | Qualifications, citations et réputation professionnelle | Autorisations réglementaires (approbation FDA), données d’essais cliniques, affiliations institutionnelles et audits tiers |
| Atténuation des biais | Représentation équitable sur l’ensemble des populations | Validation sur différentes populations de patients avec des évaluations d’équité documentées et des résultats de tests de biais |
La FDA (Food and Drug Administration) joue un rôle central dans la réglementation des dispositifs médicaux intégrant l’IA, établissant des exigences pré- et post-marché pour garantir la sécurité et l’efficacité avant le déploiement clinique. La classification Software as a Medical Device (SaMD) détermine les parcours réglementaires selon le niveau de risque, les systèmes d’IA qui diagnostiquent, traitent ou surveillent des conditions médicales nécessitant généralement la supervision de la FDA. La FDA propose trois principaux parcours pré-marché : le parcours 510(k) pour les dispositifs substantiellement équivalents à des dispositifs déjà homologués (le plus courant pour les applications IA à faible risque), le parcours De Novo pour les technologies IA innovantes sans dispositif de référence, et le parcours PMA (Premarket Approval) pour les dispositifs à haut risque nécessitant des preuves cliniques approfondies. Les exigences d’évaluation des performances et de validation imposent aux développeurs de mener des tests rigoureux attestant de l’exactitude des algorithmes, de leur robustesse sur diverses populations et de leur sécurité en situation réelle, avec documentation des jeux de données d’entraînement, méthodologies de validation et métriques de performance. Le plan d’action IA/ML 2021 de la FDA et les directives ultérieures mettent l’accent sur la nécessité de la transparence algorithmique, de la surveillance des performances en conditions réelles et des protocoles de modification garantissant que les systèmes d’IA conservent leur validité clinique au fil du temps. Les organisations de santé doivent tenir une documentation réglementaire complète comprenant des études de validation clinique, des analyses de risque et la preuve du respect des directives FDA applicables tout au long du cycle de vie du dispositif.
La conformité à la HIPAA (Health Insurance Portability and Accountability Act) est obligatoire pour tout système d’IA en santé traitant des informations de santé protégées (PHI), imposant des contrôles stricts sur la collecte, le stockage, la transmission et l’utilisation des données pour l’entraînement et l’inférence des modèles IA. La Privacy Rule limite l’utilisation et la divulgation des PHI au strict nécessaire, tandis que la Security Rule impose des garanties techniques et administratives, incluant le chiffrement, les contrôles d’accès, les journaux d’audit et les procédures de notification des violations pour les systèmes IA traitant des données de santé sensibles. La dé-identification des données d’entraînement est un mécanisme de conformité essentiel, exigeant la suppression ou la transformation de 18 identifiants spécifiques pour permettre le développement de l’IA sans exposition directe aux PHI, bien que des risques de ré-identification subsistent avec l’analyse avancée. Les organisations de santé font face à des défis particuliers lors de la mise en œuvre de l’IA sous HIPAA, notamment l’équilibre entre le besoin de grands jeux de données représentatifs pour l’entraînement des modèles et les principes stricts de minimisation des données, la gestion de la conformité des prestataires tiers lors de l’externalisation du développement IA, et le maintien de pistes d’audit démontrant la conformité HIPAA tout au long du cycle de vie de l’IA. La conformité HIPAA n’est pas optionnelle mais fondamentale pour le déploiement de l’IA en santé, les violations entraînant d’importantes sanctions civiles, des responsabilités pénales et des dommages irréparables à la réputation de l’organisation et à la confiance des patients.
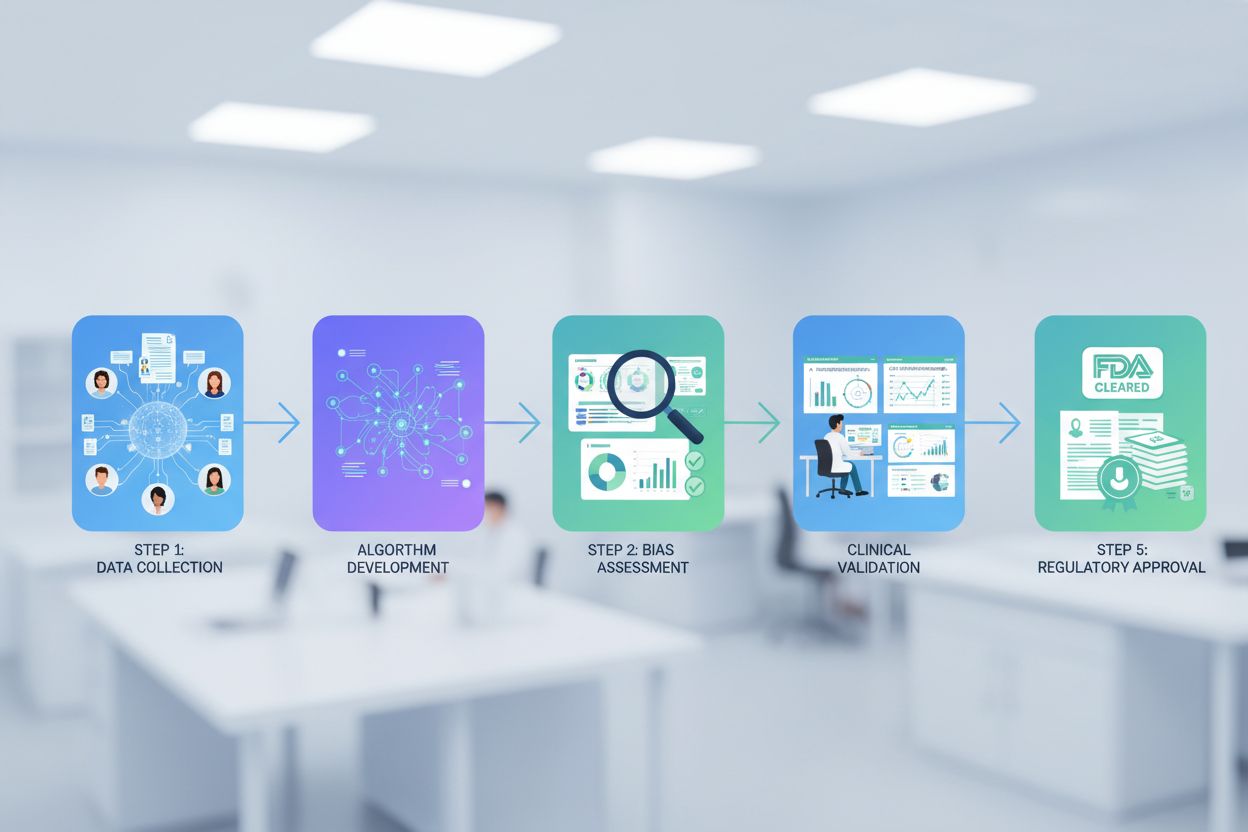
La validation clinique des algorithmes IA en santé exige des standards de preuve rigoureux démontrant que les systèmes d’IA fonctionnent de manière sûre et efficace dans les usages cliniques prévus avant un déploiement à grande échelle. Les organisations de santé doivent mettre en place des cadres de validation alignés sur la méthodologie des essais cliniques, incluant des études prospectives comparant les recommandations de l’IA aux diagnostics de référence, l’évaluation des performances sur des populations de patients variées et la documentation des modes d’échec et des cas limites où la performance de l’IA se dégrade. Les évaluations de détection des biais et d’équité sont des composantes essentielles de la validation, exigeant une analyse systématique des écarts de performance de l’IA selon la race, l’ethnie, le genre, l’âge et le statut socio-économique afin d’identifier et d’atténuer les biais algorithmiques susceptibles de perpétuer des inégalités en santé. Les exigences d’explicabilité et d’interprétabilité garantissent que les cliniciens peuvent comprendre le raisonnement de l’IA, vérifier les recommandations par rapport à leur jugement clinique et identifier les situations où les résultats de l’IA doivent être remis en question ou faire l’objet d’une enquête complémentaire. Les exigences clés suivantes forment la base d’une IA en santé cliniquement fiable :
Le RGPD (Règlement Général sur la Protection des Données) et les cadres internationaux de protection des données imposent des exigences strictes aux systèmes d’IA en santé opérant à l’international, avec un accent particulier sur le consentement du patient, la minimisation des données et les droits d’accès et de suppression individuels. L’AI Act de l’UE introduit une régulation basée sur le risque, classant l’IA en santé comme à haut risque et imposant des évaluations de conformité, des mécanismes de supervision humaine et une documentation de transparence avant mise sur le marché. Les variations régionales de la régulation IA santé reflètent des priorités politiques différentes : le Royaume-Uni maintient des standards alignés RGPD avec des recommandations sectorielles de l’Information Commissioner’s Office, l’Australie met l’accent sur la transparence et la responsabilité algorithmique via le cadre Automated Decision Systems, et le Canada exige la conformité à la LPRPDE (Loi sur la protection des renseignements personnels et les documents électroniques) avec des considérations propres à la santé. Les efforts d’harmonisation par des organismes internationaux comme l’ISO et l’IEC font avancer des cadres communs pour la validation IA, la gestion des risques et la documentation, bien qu’une divergence réglementaire significative subsiste selon les juridictions. La conformité mondiale est essentielle car les organisations santé et fournisseurs IA opérant à l’international doivent naviguer entre des exigences réglementaires qui se chevauchent ou s’opposent, nécessitant des structures de gouvernance respectant les standards les plus élevés dans toutes les régions d’activité.
Une conformité efficace de l’IA en santé nécessite la mise en place de cadres de gouvernance robustes définissant les rôles, responsabilités et autorités décisionnelles pour le développement, la validation, le déploiement et la surveillance de l’IA à l’échelle de l’organisation. La documentation et les pistes d’audit sont des mécanismes clés de conformité, exigeant des archives complètes des décisions de développement algorithmique, des protocoles et résultats des études de validation, des processus de revue clinique, de la formation des utilisateurs et de la surveillance des performances, permettant de démontrer la conformité lors d’inspections réglementaires ou de procédures judiciaires. La surveillance post-commercialisation et les protocoles de suivi continu garantissent que les systèmes IA déployés conservent leur validité clinique dans le temps, avec collecte systématique de données de performance réelle, identification de la dégradation des performances ou de nouveaux problèmes de sécurité, et procédures documentées de réentraînement ou modification des algorithmes. La gestion des fournisseurs et les programmes de conformité tiers établissent des exigences contractuelles, des procédures d’audit et des standards de performance garantissant que les développeurs externes, fournisseurs de données et prestataires de services respectent les attentes de conformité organisationnelles et les obligations réglementaires. Les organisations santé doivent mettre en place des structures de gouvernance incluant des comités consultatifs cliniques, des comités de conformité et des équipes transverses responsables de la supervision IA ; établir des pistes d’audit documentant toutes les décisions et modifications importantes ; réaliser des revues régulières de surveillance post-commercialisation ; et maintenir des accords fournisseurs détaillant les responsabilités de conformité et les standards de performance.
Les organisations santé font face à d’importants écarts de conformité dans les pratiques actuelles de déploiement de l’IA, notamment l’insuffisance de validation clinique des algorithmes avant leur utilisation, une évaluation inadéquate des biais sur des populations diverses et une transparence limitée concernant l’implication de l’IA dans la prise de décision clinique. Le paysage réglementaire continue d’évoluer rapidement, avec des directives FDA, des standards internationaux et des cadres politiques santé fréquemment mis à jour, créant une incertitude de conformité pour les organisations cherchant à implémenter des technologies IA de pointe tout en respectant la réglementation. Les outils et technologies émergents renforcent les capacités de surveillance de la conformité ; par exemple, des plateformes telles qu’AmICited aident les organisations à suivre la manière dont les systèmes IA santé et les informations de conformité sont référencés dans l’écosystème IA plus large, offrant une visibilité sur l’intégration des marques santé et des recommandations réglementaires dans d’autres systèmes IA. Les tendances futures de la conformité vont vers une surveillance accrue des performances réelles, la transparence et l’explicabilité algorithmiques, l’évaluation de l’équité, et des cadres de validation continue considérant le déploiement IA comme un processus permanent plutôt qu’un événement ponctuel d’approbation. Les organisations santé doivent adopter des stratégies de conformité proactives anticipant l’évolution réglementaire, investir dans l’infrastructure de gouvernance et l’expertise clinique, et conserver la flexibilité nécessaire pour s’adapter à mesure que les standards et les attentes progressent.
La conformité de l’IA en santé fait référence au respect, par les systèmes d’intelligence artificielle, des normes réglementaires, juridiques et éthiques qui régissent leur développement, leur déploiement et leur fonctionnement dans le secteur de la santé. Elle englobe les exigences en matière d’exactitude médicale, de sécurité des patients, de protection des données et d’efficacité clinique, garantissant que les systèmes d’IA satisfont aux normes YMYL et aux exigences de validation fondées sur des preuves avant leur déploiement clinique.
YMYL (Your Money or Your Life) est un concept de qualité de recherche Google identifiant les contenus susceptibles d’avoir un impact significatif sur la santé et le bien-être des utilisateurs. Les systèmes d’IA en santé doivent répondre aux normes YMYL en veillant à ce que toutes les allégations médicales soient étayées par des preuves cliniques, en divulguant clairement l’implication de l’IA et en maintenant une documentation transparente des sources de données d’entraînement et des méthodologies de validation.
Les principaux cadres réglementaires incluent la supervision de la FDA pour les dispositifs médicaux intégrant l’IA, la conformité HIPAA pour les systèmes traitant des informations de santé protégées, le RGPD et l’AI Act de l’UE pour la protection internationale des données, ainsi que les normes régionales au Royaume-Uni, en Australie et au Canada. Chaque cadre établit des exigences spécifiques en matière de sécurité, d’efficacité, de confidentialité et de transparence.
La validation clinique est un processus de test rigoureux visant à démontrer que les systèmes d’IA fonctionnent de manière sûre et efficace dans les cas d’utilisation cliniques prévus. Elle comprend des études prospectives comparant les recommandations de l’IA aux diagnostics de référence, l’évaluation des performances sur des populations de patients diverses, la détection des biais et l’évaluation de l’équité, ainsi que la documentation de l’explicabilité et de l’interprétabilité pour la compréhension des cliniciens.
La conformité HIPAA est obligatoire pour tout système d’IA en santé traitant des informations de santé protégées (PHI). Elle exige des contrôles stricts sur la collecte, le stockage, la transmission et l’utilisation des données dans l’entraînement des modèles d’IA, notamment le chiffrement, les contrôles d’accès, les journaux d’audit, les procédures de notification des violations et la dé-identification des données d’entraînement pour supprimer ou transformer 18 identifiants spécifiques.
La FDA supervise les dispositifs médicaux intégrant l’IA grâce à des parcours pré-marché, notamment l’homologation 510(k) pour les dispositifs substantiellement équivalents, la classification De Novo pour les technologies IA innovantes et l’approbation PMA pour les dispositifs à haut risque. La FDA exige une documentation complète du développement des algorithmes, des études de validation, des mesures de performance, de la surveillance en conditions réelles et des protocoles de modification tout au long du cycle de vie du dispositif.
Les principaux défis incluent une validation clinique insuffisante avant le déploiement, une évaluation inadéquate des biais sur des populations de patients diverses, une transparence limitée concernant l’implication de l’IA dans les décisions cliniques, l’équilibre entre la minimisation des données et les besoins d’entraînement des modèles, la gestion de la conformité des prestataires tiers et la navigation dans des environnements réglementaires en rapide évolution et multiples juridictions.
Les organisations peuvent utiliser des plateformes de surveillance de l’IA telles qu’AmICited pour suivre la manière dont leurs marques santé, informations de conformité et orientations réglementaires sont référencées dans des systèmes d’IA comme ChatGPT, Perplexity et Google AI Overviews. Cela offre une visibilité sur l’intégration des normes de conformité en santé dans les écosystèmes IA plus larges et permet d’identifier les risques de mauvaise représentation de l’information médicale.
Suivez comment votre marque santé et vos informations de conformité sont référencées dans les systèmes d’IA tels que ChatGPT, Perplexity et Google AI Overviews avec AmICited.

Découvrez comment créer du contenu santé fiable en appliquant les principes E-E-A-T. Découvrez des stratégies pour établir l’autorité médicale, l’expertise et l...

Découvrez comment les organisations de santé mettent en œuvre et développent avec succès des initiatives d’IA. Découvrez les stratégies clés pour l’infrastructu...

Découvrez les meilleures pratiques pour l’optimisation éthique de l’IA, incluant les cadres de gouvernance, les stratégies de mise en œuvre et les outils de sur...
Consentement aux Cookies
Nous utilisons des cookies pour améliorer votre expérience de navigation et analyser notre trafic. See our privacy policy.